随着环境污染及生育年龄的推迟,不孕不育率越来越高,WHO已将不孕不育症、癌症、心脑血管疾病列为当今影响人类健康的三大疾病。据统计,我国平均每8对育龄夫妇中就有1对不能正常受孕。试管婴儿技术可有效解决不孕不育难题,自1978年世界上首例试管婴儿在英国诞生以来,全世界试管婴儿数已超过六百万,胚胎植入前诊断/筛查(PGD/PGS)技术可以有效的提高试管婴儿的成功率。
2015年4月25日,在中国遗传学会遗传咨询分会—复旦大学第一期遗传咨询师培训班上,北京大学第三医院院长、妇产科主任、生殖医学中心主任乔杰做了《生殖遗传医学的进展和单细胞PGD/PDS》报告,重点讲述了PGD/PGS的定义、临床应用,以及最新应用于生殖医学领域的MALBAC技术,并对其未来发展做了预测。
胚胎植入前遗传学诊断/筛查(PGD/PGS)的定义
PGD/PGS是胚胎植入前遗传学诊断/筛查(Preimplantation Genetic Diagnosis/Screening),是指在人工辅助生殖过程中,对胚胎进行种植前活检和遗传学分析,以选择无遗传学疾病的胚胎植入子宫,从而获得正常胎儿的诊断/筛查方法。
这两种技术均建立在试管婴儿基础之上,都可以直接筛除有问题的、不健康的胚胎,挑选正常的胚胎植入子宫,可有效避免遗传病患儿的出生,阻断致病基因的纵向传递,从而获得正常的妊娠,提高患者的临床妊娠率,避免因引产给孕母带来的身心创伤。

生殖遗传学诊断/筛查使用的技术
过去20年间,胚胎植入前遗传检测主要通过卵裂球活检结合聚合酶反应(PCR)或荧光原位杂交(FISH),对胚胎的单基因遗传异常以及有限的染色体异常进行检测。近年来胚胎植入前遗传检测技术提高,出现一些新兴的遗传检测方法,例如微阵列-比较基因组杂交(Array-CGH)以及单核苷酸多态性微阵列(SNP-array)技术,它们使得同时检测23条染色体成为可能,并能以更高的精度检测小片段染色体的拷贝数变化、以及结构改变等。这使得胚胎植入前遗传检测的应用价值不仅在于可排除遗传异常胚胎,更可用于提高大龄生育、反复流产等不孕不育人群的受孕率。
PCR技术1985年首次应用于遗传病基因诊断,目前已有近百种遗传病可用PCR 技术进行诊断和产前诊断。由于PCR技术可将微量的DNA扩增数百万倍,因此它适应适用于各种来源的DNA标本,包括羊水穿刺、绒毛采样、脐血胎儿血液采集、胎儿活检、母外周血分离胎儿细胞、宫颈刷取细胞及着床前取细胞等。PCR技术在PGD中也面临着一些问题:

荧光原位杂交技术(fluoresence in situ hybirdization,F I S H)是一种将分子生物学(探针)与细胞遗传学(染色体)结合,检测染色体异常的新技术。与传统的细胞遗传学方法相比,其优势在于:(1)无需细胞培养,间期细胞即可用于杂交分析。(2)检测时只需计数间期细胞核上不同的杂交点,比传统的核型分析操作简单。(3)与核型条带分析方法相比,运用特定探针检测更敏感,更具特异性,特别是对染色体微小片段异常的检测,更有针对性。FISH也可检测和定性标记染色体,因此非常适用于临床染色体异常疾病的产前诊断。然而,FISH技术一次只能检测一个或几个候选位点,且需要细胞遗传学家对每一例标本进行评判,这一过程平均要花费5-7个小时甚至更多的时间:
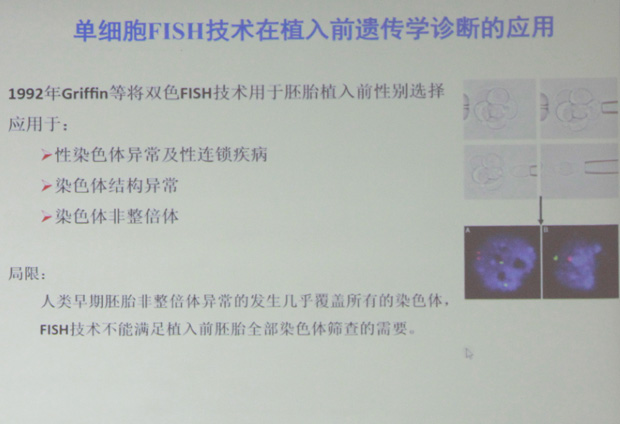
比较基因组杂交(comparative genomic hybridization, CGH)技术是在FISH技术的基础上发展起来的一种新的分子细胞遗传学技术。该技术不需细胞培养,一次杂交实验即可在整条染色体或染色体区带水平对不同基因组间DNA序列拷贝数的差异进行检测并定位,其在生殖遗传学方面的临床应用及面临问题如下:
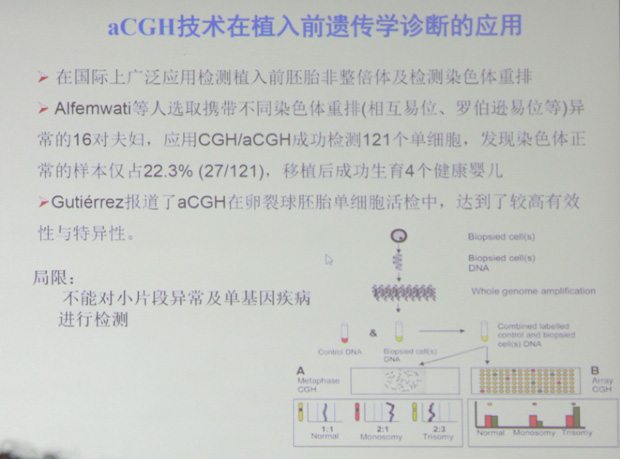
SNP-array技术,即单核苷酸多态性微阵列(single nucleotide polymorphism array)技术,它能够检测出大量的细微DNA改变和与染色体拷贝数(非整倍体)或染色体结构重排有关的异常改变。SNP分析能够对所有的23对染色体都进行分析,不过其也有临床应用局限:

单细胞测序为PGD/PGS提供了有力的工具
单细胞全基因组测序技术是在单细胞水平对全基因组进行扩增与测序的一项新技术,其原理是将分离的单个细胞的微量全基因组DNA进行扩增,获得高覆盖率的完整基因组后进行高通量测序。2011年,《自然方法》杂志( Nature Methods )将单细胞测序列为年度值得期待的技术之一,2013年,《科学》杂志(Science)将单细胞测序列为年度最值得关注的六大领域榜首。单细胞测序技术出现以后,就被迅速应用到生殖医学领域,为人们研究人类胚胎发育、获知全部基因组信息提供了有力的工具。
谢晓亮教授是我国单细胞测序领域的领军人物,他带领研究组创建了一种新的人单细胞全基因组测序技术——多重退火成环循环扩增技术(Multiple Annealing and Looping-Based Amplification Cycles, MALBAC),这是迄今为止在单细胞测序及相关领域最先进的技术。MALBAC利用特殊的引物,使得扩增子结尾互补成环,防止了DNA的指数性扩增,解决了扩增偏倚,同时保持了90%以上的基因组扩增覆盖度,使得检测单细胞中较小的DNA序列变异变得更容易,分辨率提高,可以检测单基因突变,以及同时检测多个基因。
MALBAC技术发明之后,已陆续用于对人类单个细胞、单个精子细胞、单个卵母细胞等测序,并在实际临床应用中取得了良好的效果:
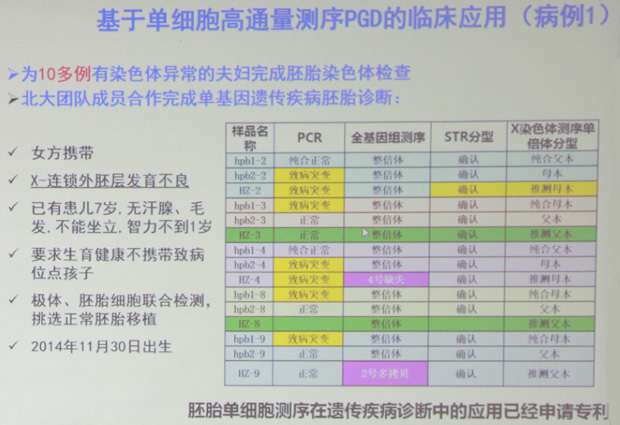
案例1:
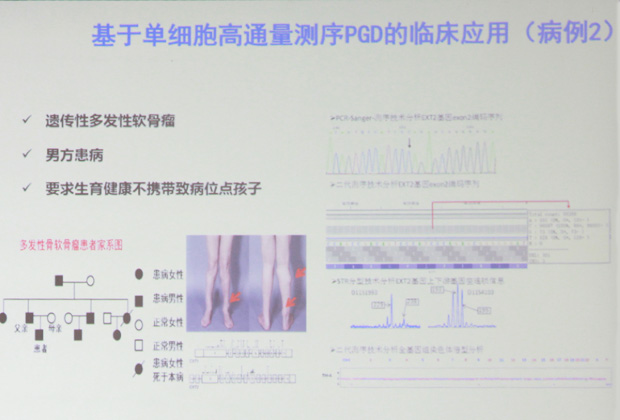
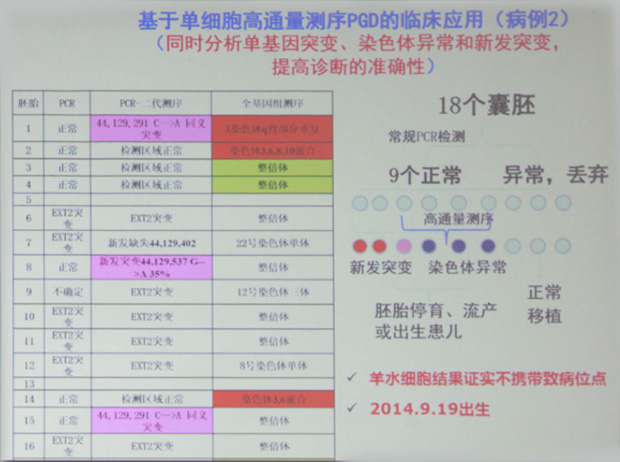
案例2:
预测:下一个PGD新技术的出现可能来自表观遗传学
最后,乔杰教授对PGD的发展进行了预测,她表示,与单细胞发展历程相似,表观遗传学正成为主流。
表观遗传是指在基因的DNA序列没有发生改变的情况下,基因功能发生了可遗传的变化,并最终导致了表型的变化。表观遗传的现象很多,已知的有DNA甲基化(DNA methylation)、基因组印记(genomic impriting)、母体效应(maternal effects)、基因沉默(gene silencing)、核仁显性、休眠转座子激活和RNA编辑(RNA editing)等。
孕妇血浆中胎儿表观遗传学标志物可作为一个定性标志物用于检查实验结果是否存在假阴性的指标,也可作为一个定量标志,用于筛查妊娠相关性疾病。目前已有较多胎儿表观遗传学标志被发现,部分已用于临床相关疾病的筛查。通过诊断表观遗传学的改变,可以获知胎儿的健康状况。表观遗传学就好似一面镜子,对疾病有直观地反映,因此研究表观遗传学的改变就成了一项重要的课题。
2012年,英国剑桥大学报道了生殖细胞重新DNA甲基化的机制,同年,美国报道了哺乳动物早期胚胎基因组规模的、碱基分辨率的DNA甲基化时间轴。
2013年,Science杂志报道了美国以人和小鼠大脑皮层顶叶为研究对象,发现了整个哺乳动物脑发育过程中整个表观遗传学重构情况,分辨率达到单个碱基。乔杰研究组与北大汤富酬教授等4个团队共同研究了人脑全基因组hmC和mC图谱,提示hmC在调节剪切及基因表达中的新作用。
2014年,乔杰课题组在Nature杂志发表了人类早期胚胎的DNA甲基化图谱,在同一期还有另两篇研究人类早期胚胎表观遗传学的文章。到现在为止,诊断表观遗传学的方法和技术在不断地推陈出新,这些都打破了传统模式上产前诊断的限制,进一步开拓了从母体血浆中胎儿DNA上疾病诊断的医学区域,使得无创诊断开始以一种全新的面貌出现在人们眼前,因此,乔杰教授预测,下一个PGD新技术的出现可能来自表观遗传学。



