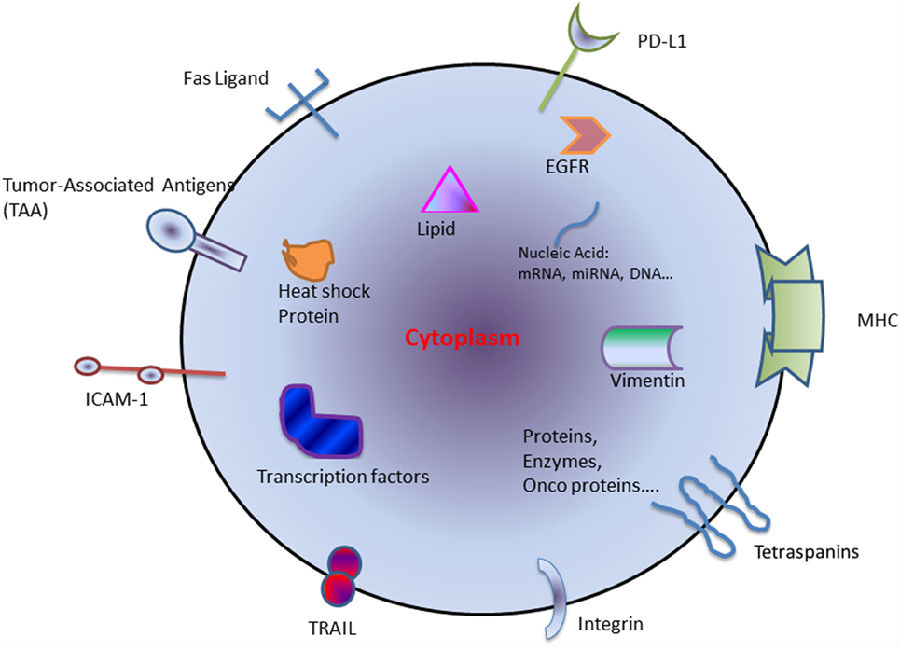
肺癌是全球最常见癌症之一,也是癌症相关死亡的主要原因。肺癌的两种组织学亚型为NSCLC和SCLC,其中NSCLC包含80%以上的肺癌,如腺癌,鳞状细胞癌和大细胞癌。外泌体是起源于大多数细胞的小囊泡,广泛分布于生物体液,如唾液,血浆,尿液和母乳中。外泌体能够通过转移其内含物,如RNA(mRNA和非编码mRNA),DNA(mtDNA,ssDNA和dsDNA),蛋白质和脂质,实现细胞-细胞通讯。这种通讯影响受体细胞的生理学过程,并可能参与病理状态,如癌症。
衍生自肿瘤细胞的外泌体称为肿瘤衍生外泌体(TEX)。TEX是肿瘤和宿主细胞之间细胞内通讯的主要机制,并且使癌细胞能够调节自身周围环境,以利于肿瘤发生和进展。TEX含有多种不同的免疫刺激和免疫抑制因子,这些因子支持受体细胞的细胞重编程。TEX可能通过形成转移前生态位以及引导扩散的肿瘤细胞至潜在的转移部位来驱动转移。相反,TEX还可以通过调节NK细胞上的杀伤细胞凝集素样受体K1(KLRK1或NKG2D)的表达诱导抗肿瘤免疫反应,从而影响其功能。
TEX在肺癌微环境中的作用
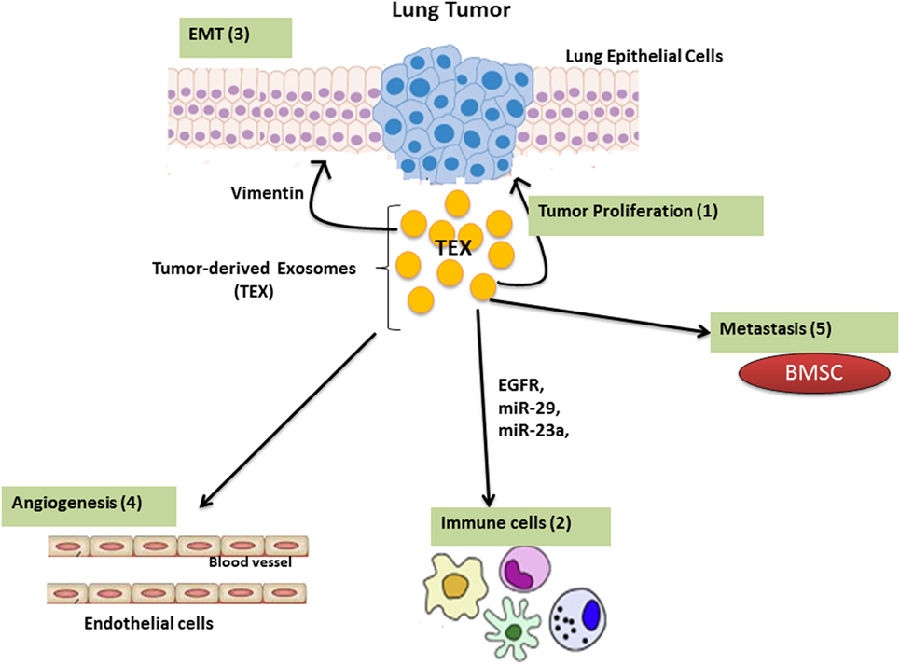
肿瘤微环境由基于肿瘤起源,具有多种特质的不同成分组成,其中最丰富的成分为癌细胞,免疫细胞,细胞外基质和基质组织。肿瘤微环境的分子和细胞通过调节局部免疫反应,决定肿瘤良恶性。TEX含有刺激性和抑制性成分,参与调节免疫应答,上皮-间质转化(EMT)和肿瘤相关成纤维细胞的功能,并且在血管生成中起关键作用。
肿瘤衍生外泌体与免疫反应
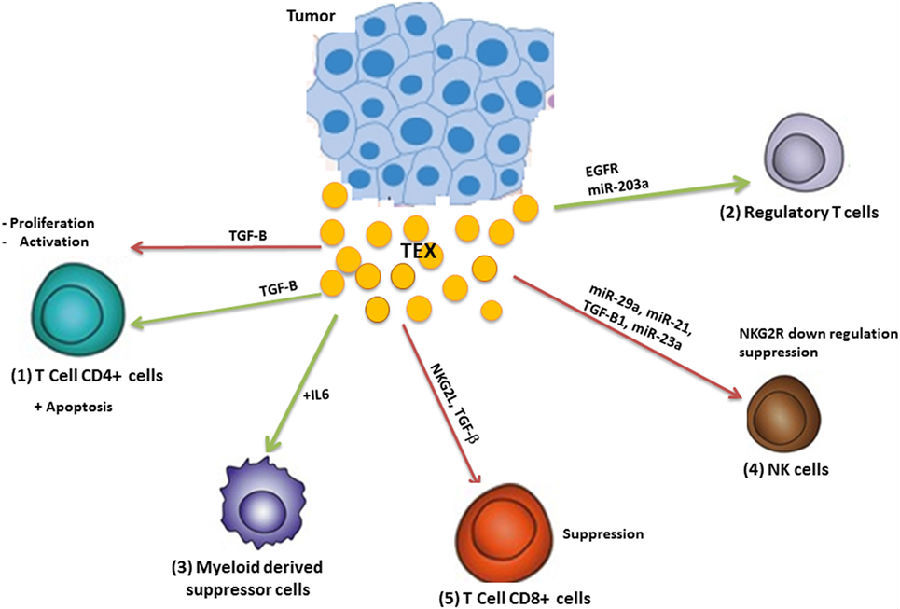
免疫系统对癌症结果具有重要影响。免疫系统可以摧毁癌细胞,抑制肿瘤生长,支持慢性炎症,并抑制引起肿瘤进展的抗肿瘤免疫力,在癌症中起到“双刃剑”的作用。
NK细胞
肺癌细胞相关TEX含有miR-21和-29a,二者均与免疫细胞表面细胞内toll样受体(TLR)结合,从而触发促转移炎性反应。
NK中,C型凝集素样受体NKG2D作为活化受体,触发表达其配体的癌细胞毒性。低氧肿瘤细胞源性TEX通过将转化生长因子(TGF)-β1传送至NK细胞,并随后减少NKG2D表达来抑制NK细胞的功能。TEX衍生miR-23a可以直接靶向CD107a-一种保护NK免受颗粒降解的分子。
肿瘤衍生外泌体也可以下调NK上NKG2D表达,这将导致受体脱敏和内化,并降低NK细胞的活性。TEX还可能通过其他机制降低NK活性,如白细胞介素(IL)-2介导的通路下调,抑制穿孔素或细胞周期蛋白D3产生以及引发NK介导的细胞溶解失败的 (Jak)3活化。
DC与MDSC
众所周知,肿瘤微环境可以“驯化”DC以促进肿瘤发展。TEX穿梭在信号分子和肿瘤抗原中,在细胞-细胞通讯中发挥重要作用。
近80%分离自肺癌活检组织的外泌体含有EGFR,EGFR可能诱导致耐受性DC和调节性T细胞,最终导致肿瘤抗原特异性CD8+细胞受抑制。TEX还可以防止DC成熟和功能。黑色素瘤和结直肠癌中,TEX促进CD14+单核细胞分化为MDSC,而不是DC。MDSC是人和小鼠骨髓细胞不成熟群体,在肿瘤中扩展,具有强烈的抑制抗肿瘤免疫应答作用。TEX与单核细胞相互作用,引起单核细胞表型,其主要特征为共刺激分子未上调,CD14表面表达不变,人类白细胞抗原-DR表达降低。总之,TEX将单核细胞分化为DC,并促进维持不成熟的单核细胞状态。这些细胞自发地分泌免疫抑制性细胞因子,如TGF-β和前列腺素E2(抑制T细胞增殖和抗肿瘤功能)。
然而,体内总效应可能很复杂。小鼠静脉注射TEX引起MDSC累积,炎性介质,如IL-6和VEGF产生显著增加。另一方面,MDSC累积使免疫抑制性因子产生增加。这两个过程均导致肿瘤进展。TEX表面上的热休克蛋白72(HSP72)可能触发MDSC中STAT3活化,并产生自分泌IL-6。
肿瘤相关巨噬细胞(TAM)
肿瘤相关巨噬细胞是肿瘤微环境中调节血管生成,侵袭,转移以及肿瘤基质中免疫抑制性的主要调节因子。肿瘤进展期间,循环单核细胞和其它炎性淋巴细胞被募集至肿瘤组织中,并改变肿瘤微环境。单核细胞是TAM的前体,TEX在单核细胞存活和肿瘤炎性生态位内TAM生成中起关键作用。TEX通过传递功能性受体酪氨酸激酶触发单核细胞中的促分裂原活化蛋白激酶(MAPK)通路,进而抑制凋亡相关半胱氨酸天冬氨酸蛋白酶。
TEX表面上的Hsp72和棕榈酰化蛋白也调节TLR信号传导和TAM的功能。因此,TEX通过TLR2,触发NF-kB信号通路促进促炎性细胞因子分泌。TEX介导肿瘤细胞与TAM之间的串扰,TEX与TAM衍生外泌体之间相互作用维持炎性生态位内TAM存活。肺癌中,TAM与肿瘤细胞相互作用引起肿瘤进展。TAM释放的外泌体对于癌症进展也很重要。肿瘤微环境中外泌体的不同机制强化了外泌体作为癌症进展主要参与者的作用。
调节性T细胞与调节性B细胞
TEX通过TGF-β和IL-10依赖性机制促进Treg和Breg增殖,从而增加它们对细胞凋亡的抗性。肿瘤衍生外泌体诱导CD4+CD25阴性T细胞转化为CD4+CD25高FOXP3+ Treg细胞。TEX含有表面CD39和CD73,直接将膜束缚CD73传递至CD39+细胞,并通过产生胞外腺苷负调节T细胞功能,从而降低局部免疫力。TEX还诱导常规CD4+T (Tconv)表面上CD69丢失,导致其功能下降。调节性B细胞是介导免疫耐受的免疫抑制性B细胞亚群。Breg产生IL-10,IL-35,TGF-β,PD-L1和IL-21等分子,并诱导Treg产生,从而通过抑制促炎细胞因子预防免疫病理事件。
TEX在肺癌EMT中的作用
上皮-间质转化(EMT)是上皮细胞获取间充质细胞特性的过程。在此过程中,上皮细胞失去了细胞极性和粘附特性,获取运动特性。这使得上皮细胞迁移至允许转移和肿瘤进展的远端部位。EMT在为癌细胞提供干细胞方面也很重要。分离自晚期肺癌患者血清的TEX含有高水平波形蛋白,TEX可以诱导受体人支气管上皮细胞中的EMT。肺癌中,波形蛋白通过调节VAV2–Rac1通路,修饰粘着斑激酶活性来改变癌细胞粘附作用。miR-23a介导TGF-β诱导的A549细胞EMT。
TEX在肺癌血管生成中的作用
血管生成对肿瘤生长和转移至关重要,受不同机制和血管生成因子调节。外泌体在血管生成中起关键作用。缺氧是肿瘤微环境的标志之一,TEX在缺氧条件下的变化使得它们能够通过血管生成缓解肿瘤微环境的应激状态。TEX相关miR-23a摄取能够靶向脯氨酰羟化酶1和2(PHD1和2),导致缺氧诱导因子-1α累积以及血管生成增强。
金属蛋白酶组织抑制剂(TIMP)-1是强烈支持肺癌进展的因子,在PI3K/Akt/HIF-1通路控制下,TIMP-1过度表达诱导了肺腺癌细胞及其衍生外泌体中致瘤性miR-210表达。反之,这些细胞释放的TEX下调EC中的Ephrin A3并促进血管生成。
肺癌转移与TEX
转移所需的主要步骤是形成转移前生态位,转移部位不是随机的,而是在转移开始之前,肿瘤细胞被修饰后选择的。相反,转移生态位在CTC到达时开始并形成。TEX在转移前生态位形成和转移过程中发挥重要调节作用。黑色素瘤衍生TEX在原发性肿瘤形成和肺转移中很重要。另外,TEX还可以将癌基因MET从黑色素瘤细胞转移至BM祖细胞,从而促进转移。外泌体靶细胞选择通过它们表面黏附分子确定。肿瘤衍生外泌体表面特异性整合素谱直接将它们引导至特定器官,从而驱动转移性亲器官性。骨骼是导致溶骨性病变的NSCLC的常见转移部位。肺是许多转移性原发肿瘤的共同靶点,这种组织特异性转移背后的确切分子机制尚未完全了解。
TEX作为生物标志物及肺癌治疗
生物标志物作为机体特定生理或生物状态指标,可用于区分正常或致病状态以及治疗反应。生物标志物可能是癌症进展,复发风险或治疗疗效的预后和预测性标志物。大量研究表明外泌体可能是肺癌“液体活检”的生物标志物。
TEX标志物可能较传统活检方法更具灵敏度和特异性。研究人员检测了肺癌衍生外泌体的标志物,如蛋白质和非编码RNA。一项以276例NSCLC患者血浆外泌体膜上附着的49种蛋白质为研究对象的分析表明,某些蛋白,如NY-ESO-1可能与存活显著相关。NSCLC患者血清外泌体miRNA微阵列分析表明,肺癌复发的患者miR-21和miR-4257显着上调。
肺癌患者中两种肿瘤抑制相关miRNA(即miR-51和miR-373)外显子表达降低,并且这种降低与预后不良有关。另外,也有研究报道了其他可作为肺癌治疗反应标志物的外泌体miRNA,如miR-208a和miR-1246分别与p21和DR5 mRNA结合以促进肿瘤生长和对放疗的抗性。CD171和CD151以及tetra-spanin 8也被认为是NSCLC的潜在诊断生物标志物。
外泌体是向目标器官传递药物和核酸的合适媒介,其在癌症治疗中具有很大的潜力。例如,外泌体运行于肿瘤特异性抗原,也可以作为抗癌疫苗。由于TEX吸收具有亲器官性,并通过整联蛋白介导的信号传导发挥作用,因此通过诱饵肽阻断整联蛋白可能是抑制外泌体融合和摄取,从而阻断肿瘤进展的良好策略。
最新肺癌免疫治疗方法之一依赖于阻断T细胞活化的负调节物,如PD-1和PD-L1以及肿瘤微环境中的炎性信号。另一种方法,如阻断外泌体释放或抑制肿瘤微环境中外泌体介导的细胞串扰可能适合抑制有利肿瘤微环境的发展。另一方面,外泌体可以调节肿瘤微环境内的抗炎信号,这可以有效增强肺癌免疫治疗疗效。
总之,外泌体可能用于癌症诊断和治疗。由于其独特的生物学特性,如特异性靶向,小尺寸,穿梭信号传导和生物分子,以及穿越生物屏障的能力;外泌体可作为诊断性生物标志物,用于药物传递以及肿瘤免疫治疗。然而,仍需进一步研究来解决外泌体生物学局限性,以便将基于外泌体的技术转化为临床应用。
参考文献:
1. Fan J, Kuai B, Wu G, et al. Exosome cofactor hMTR4 competes with export adaptor ALYREF to ensure balanced nuclear RNA pools for degradation and export[J]. EMBO J, 2017.
2. Lässer C, Alikhani VS, Ekström K, et al . Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages[J]. J Transl Med, 2011, 9:9.
3. Shamila D.Alipoor1, imageEsmaeil Mortaz, imageMohammad Varahram, imageMehrnaz Movassaghi, imageAletta D. Kraneveld, imageJohan Garssen and imageIan M. Adcock. The Potential Biomarkers and Immunological Effects of Tumor-Derived Exosomes in Lung Cancer. Front. Immunol., 18 April 2018.





