临床医生在肿瘤治疗中发现,人体肿瘤千差万别,即使是同一个部位的肿瘤,治疗效果和方法也应因人而异,这种因人、因病而采取的不同疾病治疗方法称为“个体化治疗”。如今,化疗用药是对抗肿瘤的主要“武器”,在临床治疗中约占70%。因此,在化疗用药前进行相关基因的检测,对提高化疗药物的敏感性,选用对个体毒副作用低的药物来治疗癌症具有关键意义。
伊立替康药具有较为广谱的抗肿瘤活性,广泛用于胃癌、结直肠癌等实体瘤的化疗。而该药的主要不良反应为胃肠道的反应,如腹泻、恶心、呕吐等症状比较常见。
伊立替康的作用机制
伊立替康是喜树碱类前药,在体内经羧酸酯酶代谢为活性物质SN-38。SN-38通过与DNA拓扑异构酶Ⅰ(介导DNA双链解旋)和DNA形成三联复合物,引起肿瘤细胞DNA损伤,干扰其转录和复制,发挥杀伤肿瘤活性。
伊立替康在体内的活性物质SN-38主要在UGT1A1的催化下灭活,生成无活性的SN-38G,从而保护细胞免受伊立替康的毒性。
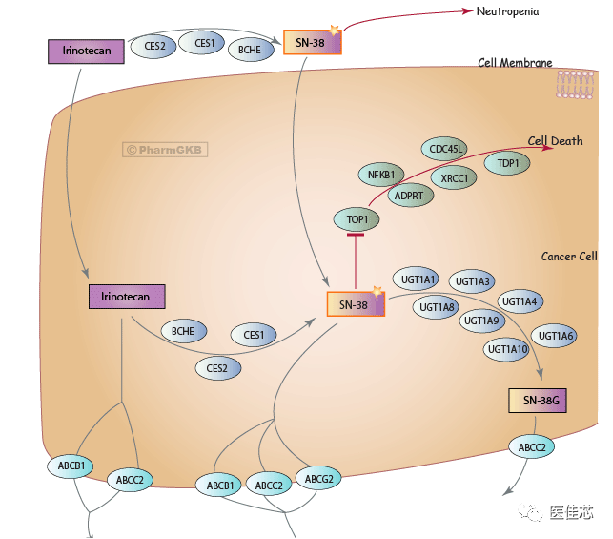
药物不良反应是目前限制伊立替康临床应用的主要问题
伊立替康化疗过程中毒副反应发生率较高,特别是迟发型腹泻(用药24小时后发生)和中性粒细胞减少较为明显。大量临床患者由于无法耐受这些毒副反应而被迫终止治疗,严重的药物不良反应甚至可以直接导致患者死亡。
有数据显示,接受伊立替康治疗的患者中,有20%的患者会发生3-4级腹泻,10%的患者会出现较为严重的中性粒细胞减少。
伊立替康的基因多态性
-
UGT1A1基因多态性与伊立替康毒性反应的发生密切相关
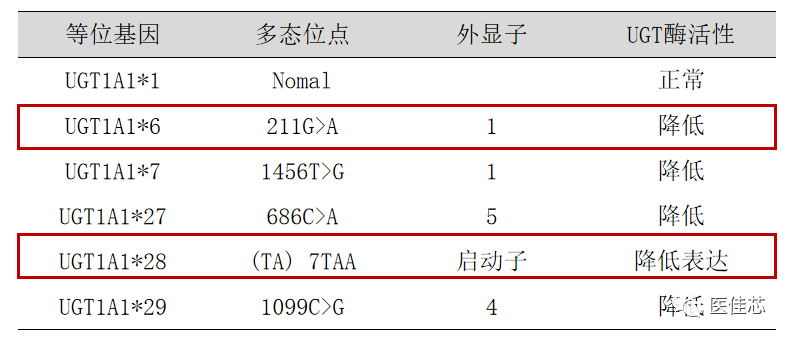
UGT1A1基因启动子区插入缺失多态性,TA序列重复6次(TA6)为野生型(UGT1A1*1),重复7次(TA7)为突变型(UGT1A1*28) 。
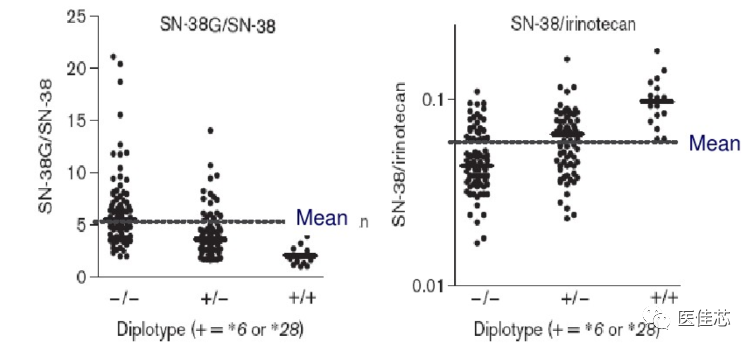
UGT1A1*28和UGT1A1*6突变降低UGT1A1功能降低SN38的葡萄糖醛酸化,使SN-38蓄积。
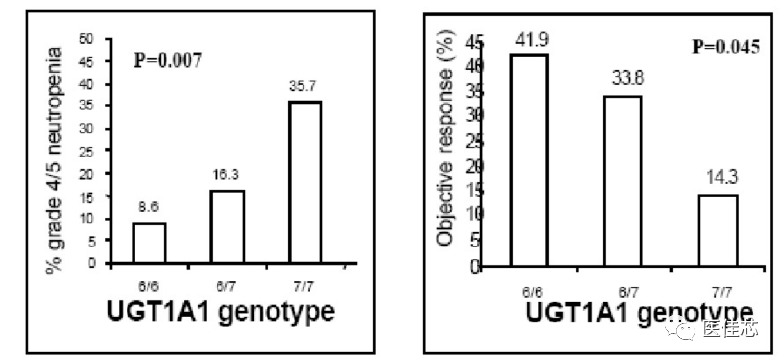
美国NIH的遗传药理学研究计划中:N9741项目,收集524例使用伊立替康化疗的结直肠癌病人,发现UGT1A1*28携带者造血系统毒性明显升高。
美国FDA明文规定UGT1A1*28突变的纯合子和杂合子个体发生严重不良反应的风险极大地增加了(约7倍)应当严加监控。
中国人中,野生型纯合子(6/6)杂合子(6/7)和突变纯合子(7/7)的发生频率分别为70.2%、277%、2.1%。
伊立替康的基因多态性研究
1
Hu Zhe-Yi et al于2010年发表在《European journal of cancer 》上的一项纳入包含1760名接受伊立替康治疗癌症患者的20篇研究的荟萃分析,研究UGT1A1*28和严重腹泻之间的关系。
研究显示:UGT1A1*28携带者在使用中、高剂量的伊立替康治疗时,发生严重腹泻的风险增加。
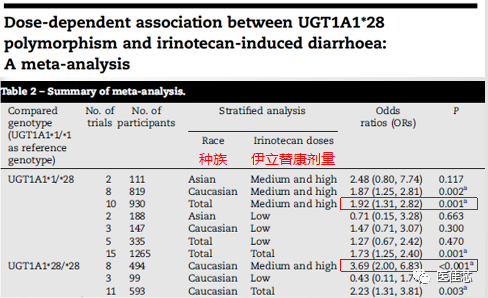
研究显示:
UGT1A1*28/*28基因型的患者,中、高剂量的伊立替康的严重腹泻的风险高于UGT1A1*1/*1基因型的患者(OR=3.69;P< 0.001)。
UGT1A1*1/*28基因型的患者,中剂量和高剂量的伊立替康的严重腹泻的风险高于UGT1A1*1/*1基因型的患者(OR=1.92;P = 0.001)。但这种关联在低剂量伊立替康中没有发现。
2
Liu Chun-Yu et al 于2008年一项发表在《Cancer》上的一项纳入128名既往接受伊立替康治疗的转移性结直肠癌患者的研究,分析UGT1A1*28对伊立替康毒性和治疗效果的影响。
研究显示:UGT1A1*28多态性降低UGT1A1 酶活性,引起接受伊立替康治疗患者的严重毒性反应。
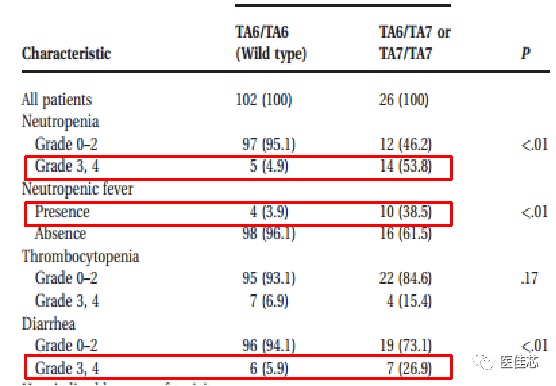
结果:TA6/TA7或TA7/TA7基因型的患者3级或4级中性粒细胞减少 (53.8% vs 4.9%; P< 0.01),中性粒细胞性发热(38.5% vs 3.9%; P<0.01)、腹泻(26.9% vs 5.9%; P<0.01)明显增加;
结论:UGT1A1*28多态性可预测转移性结直肠癌患者接受伊立替康治疗的严重毒性。
3
研究显示:中国患者UGT1*28多态性频率低,*28/*28纯合突变患者发生Ⅲ度中性粒细胞减少和腹泻风险增加。

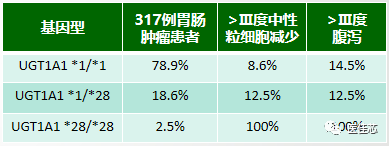
结果:在中国人UGT1A1*28基因多态性低,野生型 TA6/6占大多数,对伊立替康的严重毒性反应发生率低。UGT1A1*28/*28患者相对于*1/*28和*1/*1患者,发生中性粒细胞减少和腹泻的风险增加。
4
研究显示:UGT1A1*28多态性可预测伊立替康化疗引起腹泻、呕吐和疲劳的风险,有助于识别伊替康化疗后出现严重或潜在危及生命毒性的高危患者。

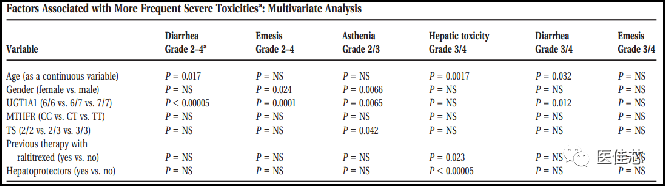
研究结果:UGT1A1*28多态性是腹泻、呕吐和疲劳的危险因素,具有显著的统计学意义。UGT1A1*28/*28基因型患者服用伊立替康,其腹泻、呕吐和疲劳虚弱的风险更高。
5
研究显示:UGT1A1 *6位点突变与伊立替康治疗的肿瘤患者中性粒细胞减少和严重腹泻的风险增加有关。
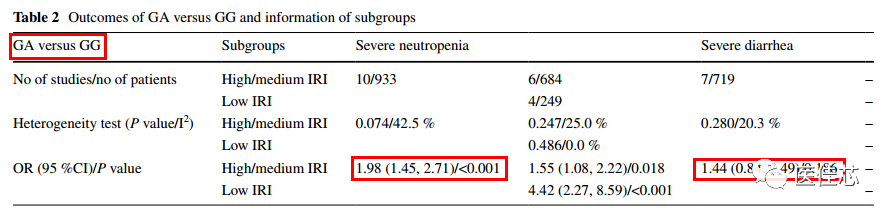
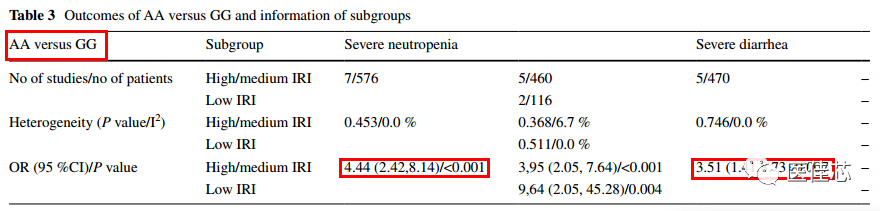
研究结果:UGT1A1*6杂合突变的患者风险增加[优势比(OR) = 1.98, P < 0.001],纯合突变对严重中性粒细胞减少的风险更高(OR = 4.44, P < 0.001)。对于严重腹泻,UGT1A1*6杂合型无显著性危险,纯合突变型有显著性风险(OR = 3.51, P = 0.007)。
6
Li M et al于2014年发表在《Onco Targets Ther》一项纳入2009年至2012年确诊为转移性结肠直肠癌的167名患者的回顾性分析,探讨UGT1A1基因多态性与伊立替康毒性之间的关系。
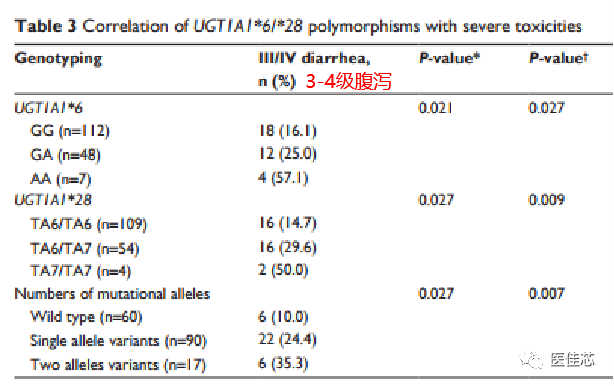
UGT1A1*6/*28多态性与严重毒性的关联研究
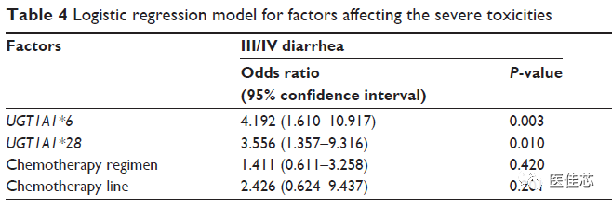
影响严重毒性因素的逻辑回归模型
研究结果:UGT1A1*6突变等位基因携带者发生3级以上腹泻的风险是野生型患者的4.19倍。UGT1A1*28突变等位基因携带者发生3级以上腹泻的风险是野生型患者的3.56倍。
7
研究显示:将UGT1A1*6和UGT1A1*28联合分析可作为亚洲人伊立替康不良反应的潜在生物标记物。

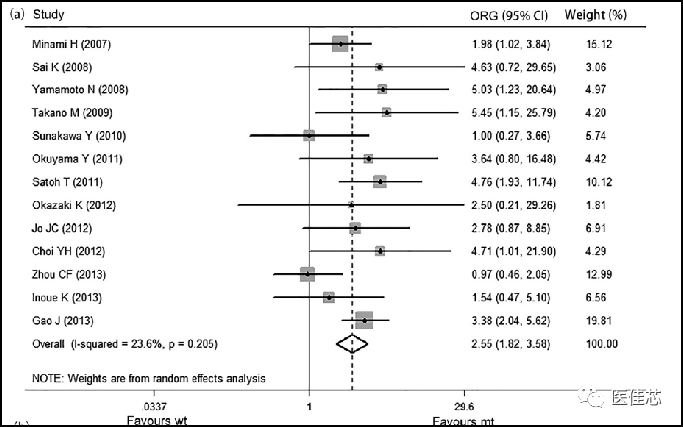
研究结果:在包含UGT1A1*6和UGT1A1*28两种基因变异的联合研究结果表明,携带突变等位基因的患者发生中性粒细胞减少的风险比未突变患者高155%。
8
王日铭于2018年发表在《肿瘤综合治疗电子杂志》上的一项纳入132 例胃肠肿瘤患者的研究, UGT1A1 基因不同亚型患者应用不同剂量强度的伊立替康,突变型患者周剂量强度低于野生型患者( UGT1A1*28 基因野生型、杂合突变型、纯合突变型肠癌患者伊立替康中位周剂量强度分别为57.9、52.9、33.6 mg/m2 ;UGT1A1*6 基因野生型、杂合突变型、纯合突变型肠癌患者伊立替康中位周剂量强度分别为 57.1、56.3、47.1 mg/m2),探讨 UGT1A1基因突变型患者减量应用伊立替康与UGT1A1 野生型患者应用标准剂量伊立替康的疗效是否存在差异。
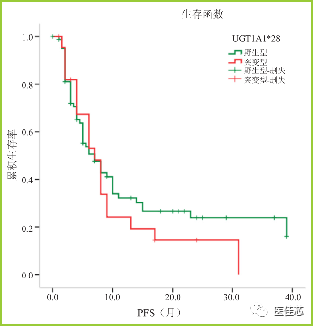
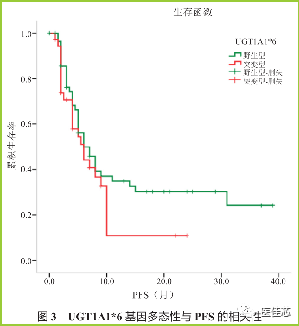
研究表明:UGT1A1*28基因野生型患者的PFS 均为 7 个月,比较差异无显著性(P=0.419)。UGT1A1*6 基因野生型及突变型患者的 PFS 均为6个月,比较差异无显著性( P=0.178 )。
伊立替康的个体化用药
基于UGT1A1*28的伊立替康个体化用药方案
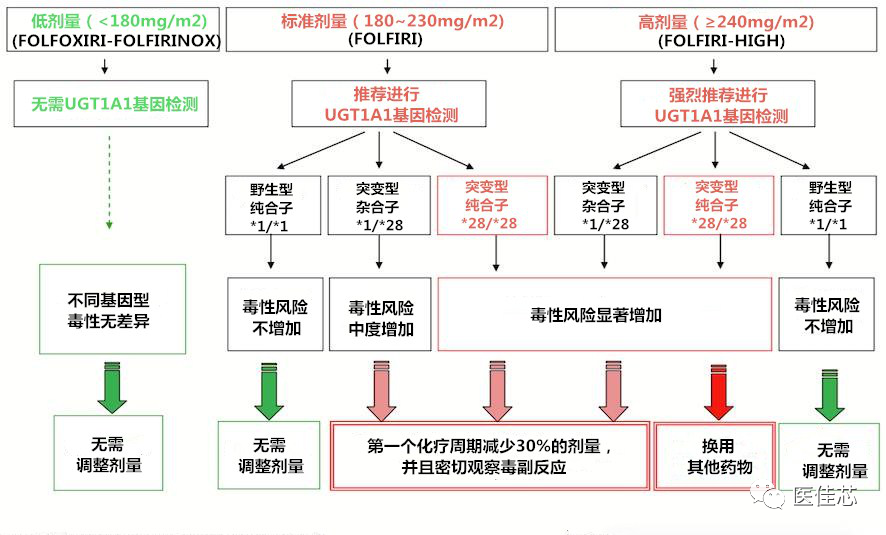
伊立替康剂量指导要点:当接受中、高剂量的伊立替康治疗时,UGT1A1*28突变型杂合子和纯合子需密切关注毒副反应,并应考虑在进行第一轮治疗时将剂量减少30%或换用其他化疗方案。
局限性:其他UGT1A1缺陷变异与非高加索人群相关,尤其是在亚洲人群中*6和*27等位基因。
伊立替康个体化用药建议
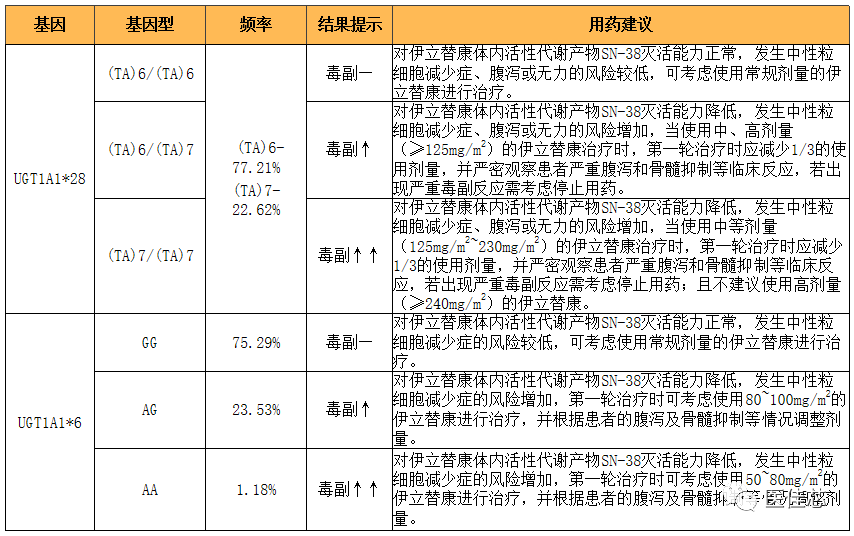
注释:“—”代表大多数人的治疗反应;“↑”、“↑↑”表示增加和显著增加。
伊立替康个体化用药基因检测适用范围
1、初次使用伊立替康(包括单独使用伊立替康化疗、联合其他抗肿瘤药物进行化疗)的胃癌、结直肠癌等实体瘤的化疗患者,确定第一轮治疗使用的药物剂量。
2、在使用伊立替康化疗过程中出现严重不良反应(如严重腹泻、中性粒细胞减少、无力疲劳等)的胃癌、结直肠癌等实体瘤的化疗患者,指导药物剂量调整。
-
阳国平, 郭成贤. 药物基因组学与个体化治疗用药决策[M]. 北京:人民教育出版社, 2016: 110-111. -
Dose-dependent association between UGT1A1*28 polymorphism and irinotecan-induced diarrhoea: a meta-analysis. European journal of cancer (Oxford, England : 1990) 2010. Hu Zhe-Yi et al. -
UGT1A1*28 polymorphism predicts irinotecan-induced severe toxicities without affecting treatment outcome and survival in patients with metastatic colorectal carcinoma. Cancer. 2008. Liu Chun-Yu et al. -
马冬,张绪超. 中国人UGT1A1*28的基因多态性以及与伊立替康毒性和疗效的关系. 中山大学学报,2011,32(4):495-499. -
Uridine diphosphate glucuronosyl transferase 1A1 promoter polymorphism predicts the risk of gastrointestinal toxicity and fatigue induced by irinotecan-based chemotherapy. Cancer. 2006. Massacesi Cristian et al. -
UGT1A1*6 polymorphisms are correlated with irinotecan-induced toxicity: a system review and meta-analysis in Asians. Cancer chemotherapy and pharmacology. 2014. Cheng Lei et al. -
Clinical signifcance of UGT1A1 gene polymorphisms on irinotecan-based regimens as the treatment in metastatic colorectal cancer. Onco Targets Ther. 2014 , Li M et al. -
The association of UGT1A1*6 and UGT1A1*28 with irinotecan-induced neutropenia in Asians: a meta-analysis. Biomarkers : biochemical indicators of exposure, response, and susceptibility to chemicals. 2014. Chen Yi-Jing et al. -
https://www.pharmgkb.org/guideline/PA166127626 -
王日铭,汪佼佼,等. UGT1A1 基因多态性与伊立替康治疗胃肠肿瘤的疗效和安全性分析[J].肿瘤综合治疗电子杂志. 2018,4(3): 51-56.



